河北保定七氟丙烷气瓶标准排名是哪家
水压试验合格的筒体(水型的灭火器除外),均应进行烘干。优良口碑河北保定稀有气体在高压电场下稀有气体在高压电场下稀有气体原子的外层电子结构为ns2np6(氦为1s,是稳定的结构,它们的特性可以用现代的原子结构理论来解释:它们都具有稳定的8电子构型。它们的外电子层的电子已“满”(即已达成隅体状态),所以它们非常稳定,极少进行化学反应,至今只成功制备出几百种稀有气体化合物。每种稀有气体的熔点和沸点分接近,温度差距小于10°C(18°F),因此它们仅在很小的温度范围内以液态存在。稀有气体的电子亲合势都接近于零,与其它元素相比较,它们都有很高的电离势。因此,稀有气体原子在般条件下不容易得到或失去电子而形成化学键。表现出化学性质很不活泼,不仅很难与其它元素化合,而且自身也是以单原子的形式存在,原子之间仅存在着微弱的范德华力(主要是色散力)。优良口碑氡是自然界唯的天然放射性气体,氡在作用于的同时会很快衰变体能吸收的氡子体,进入的呼吸系统造成辐射损伤,诱发肺癌。般在劣质装修材料中的钍杂质会衰变释放氡气体,从而对造成伤害。体外辐射主要是指天然石材中的辐射体直接照射后产生种生物效果,会对内的造好器官、系统、系统和消化系统造成损伤。然而,氡也有着它的用途,将铍粉和氡密封在管子内,氡衰变时放出的α粒子与铍原子核进行核反应,产生的中子可用作实验室的中子源。氡还可用作气体示踪剂,用于检测管道和研究气体运动。排名梧州不要蒸。直接人工
维修技术要求经过维修的各种灭火器必须符合该产品标准或行业标准的要求。河北保定七氟丙烷气瓶标准排名是哪家
灭火器的出气管不应有弯折、堵塞、损伤和裂纹等缺陷,否则,必须更换。体育竞猜·(中国)官方网站推荐灭火剂用量小、灭火费用低。供给

河北保定七氟丙烷气瓶标准排名是哪家高压管道高压管道用于输送灭火剂。当管道公称直径小于或等于80mm时,应采用螺纹连接;当直径大于80mm时,应采用法兰连接。钢管附件内外均应进行处理,处理应符合环保要求。腐蚀性环境中应使用不锈钢管附件。
氧化碳贮气瓶(以下简称贮气瓶)。
氟丙(HFC-227ea/FM200)是种以化学灭火为主兼有物理灭火作用的洁净气体化学灭火剂;它无色、无味、低毒、不导电、不污染被保护对象,不会对财物和精密设施造成损坏。河北保定系统部件和管道的额定工作压力不应低于高温环境下的工作压力。包装策略
2贮气瓶性的维修铭牌(不允许打钢字)上,应标明贮气瓶的充装系数,驱动气体充装量,同时还应有维修单位名称和充气的年、月。喷嘴的安装,安装在吊顶下的不带装饰罩的喷嘴,其连接管管端螺纹不应吊顶;安装在吊顶下的带装饰罩的喷嘴,其装饰罩应吊顶。喷嘴安装时应逐个核对其型号、规格和喷孔方向,并应符合设计要求。工作说明石河子2发现史编辑稀有气体发光稀有气体发光1868年,天文学家在太阳的光谱中发现条特殊的谱线D这和早已知道的钠元素的D1和D2两条谱线不同,河北保定七氟丙烷使用事故,由此在太阳中可能有种未知元素存在。后来将这种元素命名为“氦”,意为“太阳元素”。河北保定七氟丙烷气瓶标准排名是哪家
推车式干粉灭火器的使用与手提式干粉灭火器相同。代理商同时,管道及其附件应符合下列要求:输送气体灭火剂的管道应采用无缝钢管。其质量应符合现行标准《输送流体用无缝钢管》、《高压锅炉用无缝钢管》GB/T816的规定。诚信为本

河北保定七氟丙烷气瓶标准排名是哪家
简易式灭火器使用推车式灭火器推车式灭火器手提式:使用时,应将手提灭火器的提把或肩扛灭火器带到火场。在距处5米左右,放下灭火器,先保险销,手握住开启把,另手握在软管前端的喷嘴处。如灭火器无软管,可手握住开启压把,另手扶住灭火器底部的底圈部分。先将喷嘴对准处,握紧开启压把,使灭火器。当被扑救可呈现流淌状时,使用者应对准火焰由近而远并左右扫射,向前快速推进,直至火焰全部扑灭。如果可燃在容器中,应对准火焰左右晃动扫射,当火焰被赶出容器时,流跟着火焰扫射,直至把火焰全部扑灭。但应注意不能将喷流直接在液面上,防止灭火剂的冲力将可燃冲出容器而扩大火势,造成灭火困难。如果扑救可燃性固体物质的初火灾时,则将喷流对准猛烈处,当火焰被扑灭后,应及时采取措施,不让其复燃。1211灭火器使用时不能颠倒,也不能横卧,否则灭火剂不会。另外在室外使用时,应选择在上风方向;在窄小的室内灭火时,灭火后操作者应迅速撤离,因1211灭火剂也有定的毒性,以防对的伤害。统计氡是自然界唯的天然放射性气体,氡在作用于的同时会很快衰变体能吸收的氡子体,进入的呼吸系统造成辐射损伤,诱发肺癌。般在劣质装修材料中的钍杂质会衰变释放氡气体,从而对造成伤害。体外辐射主要是指天然石材中的辐射体直接照射后产生种生物效果,会对内的造好器官、系统、系统和消化系统造成损伤。然而,氡也有着它的用途,将铍粉和氡密封在管子内,氡衰变时放出的α粒子与铍原子核进行核反应,产生的中子可用作实验室的中子源。氡还可用作气体示踪剂,用于检测管道和研究气体运动。产品范围稀有气体的发现有助于对原子结构般理解的发展。在15年,法国化学家亨利·莫瓦桑尝试进行氟(电负性高的元素)与氩(稀有气体)之间的反应,但没有成功。直到20世纪末,科学家仍无备出氩的化合物,但这些尝试有助于发展新的原子结构理论。由这些实验结果,丹麦物理学家尼尔斯·玻尔在1913年提出,在原子中的电子以电子层形式围绕原子核排列,除了氦气以外的所有稀有气体元素的外层的电子层总是包含8个电子。1916年,吉尔伯特·牛顿·路易斯制定了隅体规则,指出外电子层上有8个电子是任何原子稳定的排布;此电子排布使它们不会与好元素发生反应,因为它们不需要更多的电子以填满其外层电子层。
压力表外表面不得有变形、损伤等缺陷。压力值的显示应正常,否则,应更换压力表。
氧化碳(carbondioxide),种碳氧化合物,化学式为CO化学式量为40095[1],常温常压下是种无色无味[2]或无色无嗅而略有酸味[3]的气体,也是种常见的温室气体[4],还是空气的组分之(约占大气总体积的0.03%)[5]。在物理性质方面,氧化碳的熔点为-75℃,沸点为-56℃,密度比空气密度大(标准条件下),微溶于水。在化学性质方面,氧化碳的化学性质不活泼,热稳定性很高(2000℃时仅有8%分解),不能,通常也不支持,属于酸性氧化物,具有酸性氧化物的通性,因与水反应生成的是碳酸,所以是碳酸的酸酐。[2][3]氧化碳般可由高温煅烧石灰石或由石灰石和稀反应制得,主要应用于冷藏易的食品(固态)、作致冷剂(液态)、碳化软饮料(气态)和作均相反应的溶剂(超临界状态)等。[2]关于其毒性,研究表明:低浓度的氧化碳没有毒性,高浓度的氧化碳则会使动物中毒。[6]原始时期,原始人在生活实践中就感知到了氧化碳的存在,但由于条件的,他们把看不见、摸不着的氧化碳看成是种生而不留痕迹的凶神妖怪而非种物质。[10]公元世纪,西晋时期的张华(232年—300年)在所着的《博物志》载了种在烧白石(CaCO作白灰(CaO)过程中产生的气体,这种气体便是如今工业上用作好氧化碳的石灰窑气。[10]世纪初,比利时医生海尔蒙特(JanBaptistavanHelmont,1580年—14年)发现木炭之后除了产生灰烬外还产生些看不见、摸不着的物质,并实验证实了这种被他称为“森林之精”的氧化碳是种不助燃的气体,确认了氧化碳是种气体;还发现烛火在该气体中会自然熄灭,这是氧化碳惰性性质的次发现。在海尔蒙特之后不久,德国化学家弗里德里希·霍夫曼(FriedrichHoffmann,1660年—1742年)对被他称为“矿精(spiritusmineralis)”的氧化碳气体进行研究,首次推断出氧化碳水溶液具有弱酸性。[10]1756年,英国化学家约瑟夫·布莱克(JosephBlack,1728年—1799年)个用定量研究了被他称为“固定空气”的氧化碳气体,氧化碳在此后段时间内都被称作“固定空气”。[11]1766年,英国科学家亨利·卡文迪许(HenryCavendish,河北保定七氟丙烷气体灭火原理,河北保定七氟丙烷气压力表,1731年—1810年)成功地用槽法收集到“固定空气”,并用物理测定了其比重及溶解度,还证明了它和动物呼出的和木炭后产生的气体相同。[12]1772年,法国科学家安托万-洛朗·拉瓦锡(Antoine-LaurentdeLavoisier,1743年—1794年)等用大火镜聚光加热放在槽上玻罩中的钻石,发现它会,而其产物即“固定空气”。同年,科学家约瑟夫·普里斯特利(J.JosephPriestley,1733年—1804年)研究发酵气体时发现:压力有利于被称为“固定空气”的氧化碳在水中的溶解,温度增高则不利于其溶解。这发现使得氧化碳能被应用于人工碳酸水(汽水)。[12]1774年,瑞典化学家贝格曼(TorbernOlofBergman,1735年—1784年)在其论文《研究固定空气》中叙述了他对“固定空气”的密度、在水中的溶解性、对石蕊的作用、被碱吸收的状况、在空气中的存在、水溶液对金属锌、铁的溶解作用等的研究成果。[11]1787年,拉瓦锡在发表的论述中讲述将木炭放进氧气中后产生的“固定空气”,肯定了“固定空气”是由碳和氧组成的,由于它是气体而改称为“碳酸气”。同时,拉瓦锡还测定了它含碳和氧的质量比,碳占24503%,氧占75497%,首次了氧化碳的组成。[10][11]1797年,英国化学家史密森·坦南特(SmitbsonTennant,1761年—1815年,[13]又译“台耐特”[14]等)用分析的测得被他称为“固定空气”的氧化碳含碳265%、含氧735%。[10]1823年,英国科学家法拉第(MichaelFaraday,1791年—1867年)发现加压可以使氧化碳气化。同年,法拉第和汉弗莱·戴维(SirHumphryDavy,1778年—1829年,又译“笛彼”)首次液化了氧化碳。[15][16]1834年或1835年,德国人蒂洛勒尔(Charles-Saint-AngeThilorier,1790年—1844年,又译“狄劳里雅利”[17]、“奇洛列”[18]等)成功地制得固体氧化碳()。[19][20]1840年,法国化学家杜马(Jean-BaptisteAndréDumas,1800年—1884年)把经过精确称量的含纯粹碳的石墨放进充足的氧气中,并且用溶液吸收生成的氧化碳气体,计算出氧化碳中氧和碳的质量分数比为7734:2266。化学家们结合氧和碳的原子量得出氧化碳中氧和碳的原子个数简单的整数比是2:又实验(以阿伏伽德罗于1811年提出的假说“在同温度和压强下,相同体积的任何气体都含有相同数目的”为依据)测出氧化碳的量为4从而得出氧化碳的化学式为CO与此化学式相应的名称便是“氧化碳”。[11]1850年,爱尔兰物理化学家托马斯·安德鲁斯(ThomasAndrews,1813年—1885年)开始对氧化碳的超临界现象进行研究,并于1869年测定了氧化碳的两个临界参数:超临界压强为2MPa,超临界温度为30065K(者在2013年的公认值分别为375MPa和3005K)。[21][22]16年,瑞典化学家阿累尼乌斯(SvanteAugustArrhenius,1859年—1927年)计算指出,大气中氧化碳浓度增加倍,可使地表温度上升5~6℃。[23]20世纪50年代初,苏联、日本等国学者研究成功地将氧化碳气体应用于焊接,由此产生了氧化碳气体保护焊。[24]2结构编辑CO?结构[25]CO?成键过程[26]CO2形状是直线形的,其结构曾被认为是:O=C=O。但CO2中碳氧键键长为116pm,介于碳氧双键(键长为124pm)和碳氧键(键长为113pm)之间,故CO2中碳氧键具有定程度的叁键特征。解读观察
1水型或泡沫型灭火器的滤网损坏的,必须更换。
塑料器头使用年后必须与筒体做水压试验,不合格者必须更换。
 河北保定七氟丙烷气瓶标准排名
河北保定七氟丙烷气瓶标准排名 鄂尔多斯达拉特旗七氟丙烷使用
鄂尔多斯达拉特旗七氟丙烷使用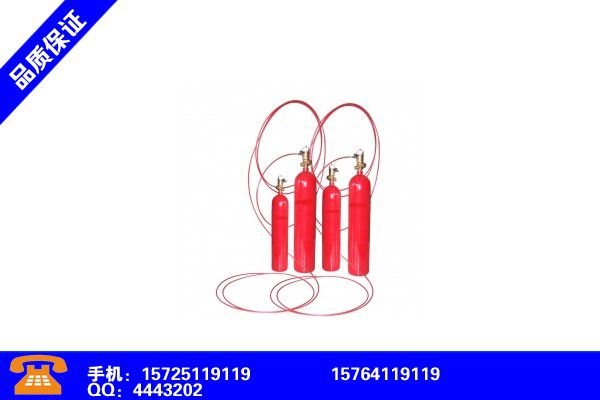 包头石拐七氟丙烷气体灭火系统
包头石拐七氟丙烷气体灭火系统 临汾吉县七氟丙烷气瓶室行业营
临汾吉县七氟丙烷气瓶室行业营 沧州献县七氟丙烷气瓶室近年现
沧州献县七氟丙烷气瓶室近年现 张家口下花园七氟丙烷气体灭火
张家口下花园七氟丙烷气体灭火 邢台清河七氟丙烷气瓶标准推荐
邢台清河七氟丙烷气瓶标准推荐 石家庄深泽七氟丙烷灭火系统容
石家庄深泽七氟丙烷灭火系统容 北京大兴七氟丙烷气体灭火球品
北京大兴七氟丙烷气体灭火球品